Segunda afinidad electrónica del oxígeno
La segunda afinidad electrónica del oxígeno es un concepto clave en química atómica y en el estudio de los procesos de formación de iones. Se refiere al cambio energético que ocurre cuando un ion oxígeno con carga negativa (O⁻) incorpora un segundo electrón para formarse como O²⁻. Este proceso ayuda a comprender por qué el oxígeno adopta configuraciones iónicas específicas en compuestos como los óxidos.
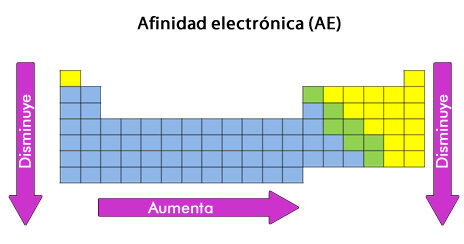
¿Qué es la afinidad electrónica?
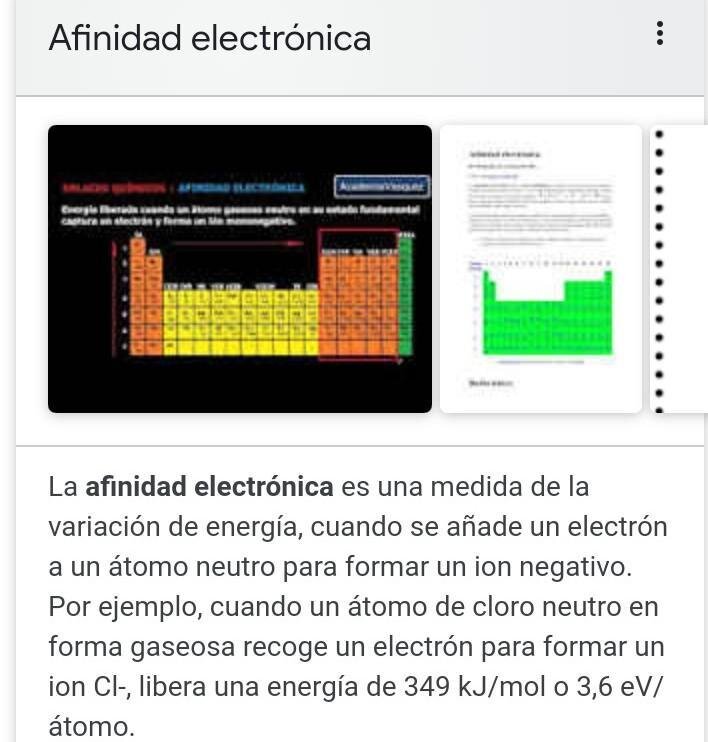
La afinidad electrónica mide la energía implicada cuando un átomo neutro en fase gaseosa capta un electrón. Puede ser:
-
Exotérmica (negativa) si se libera energía
-
Endotérmica (positiva) si se necesita absorber energía
Cuando se habla de la segunda afinidad electrónica, se analiza el proceso en un ion que ya tiene carga negativa.
Proceso de segunda afinidad electrónica del oxígeno
O−(g)+e−→O2−(g)O^-(g) + e^- rightarrow O^{2-}(g)
Este proceso implica que el oxígeno con una carga negativa previa aumenta su repulsión electrostática hacia otro electrón entrante.
¿Por qué es positiva la segunda afinidad electrónica del oxígeno?
El primer electrón que recibe el átomo de oxígeno es atraído por su núcleo y libera energía en el proceso. Sin embargo, cuando el oxígeno ya es O⁻, presenta una carga negativa que repele al segundo electrón. Para superar esa repulsión:
-
Se debe aportar energía externa
-
La energía final del sistema aumenta
Por eso la segunda afinidad electrónica es endotérmica.
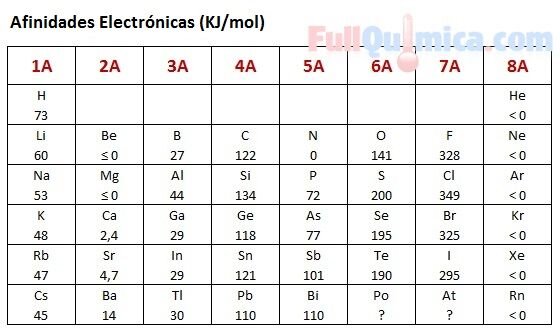
Valores energéticos aproximados
| Proceso | Cambio de energía (kJ/mol) | Naturaleza |
|---|---|---|
| Primera afinidad electrónica del oxígeno | −141 kJ/mol | Exotérmica |
| Segunda afinidad electrónica del oxígeno | +780 kJ/mol | Endotérmica |
Estos valores muestran claramente el aumento de energía requerido en el segundo paso.
Relación con la formación de compuestos
Aunque la segunda afinidad electrónica del oxígeno es energéticamente desfavorable de forma individual:
-
El oxígeno sí forma iones O²⁻ de manera estable en compuestos
-
Esto es posible porque la energía liberada en enlaces iónicos con metales es mayor que la necesaria para este proceso
Ejemplos de compuestos donde aparece el anión O²⁻:
-
Óxido de calcio (CaO)
-
Óxido de magnesio (MgO)
-
Óxido de sodio (Na₂O)
Gracias a esta compensación energética, el oxígeno es uno de los elementos más comunes en forma de óxido en la naturaleza.
Importancia en química y en el estudio de tendencias periódicas
El análisis de la segunda afinidad electrónica permite:
-
Comprender cómo se forman los aniones polivalentes
-
Explicar la estabilidad en estructuras cristalinas
-
Estudiar el comportamiento de los no metales del grupo 16 (calcógenos)
Además, sirve para identificar las diferencias energéticas entre elementos de la misma familia, ya que el oxígeno presenta una de las segundas afinidades electrónicas más altas debido a su pequeño radio atómico y elevada densidad de carga.
Idea fundamental

La segunda afinidad electrónica del oxígeno es positiva y endotérmica porque se debe superar la repulsión generada por la carga negativa del ion O⁻.

Deja una respuesta