Calcular concentración a partir de absorbancia
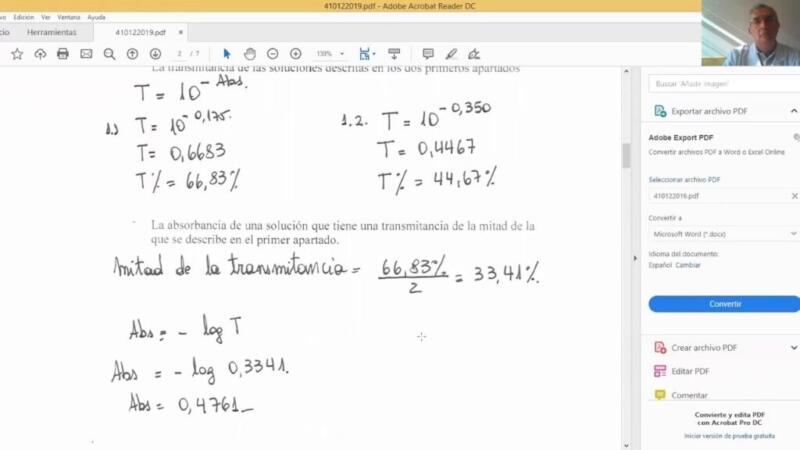
La espectrofotometría UV-Vis es una de las técnicas más utilizadas en química analítica para determinar la concentración de una sustancia en solución. Su base es la Ley de Beer-Lambert, que relaciona la absorbancia de la luz con la concentración del analito.
¿Qué es la absorbancia?
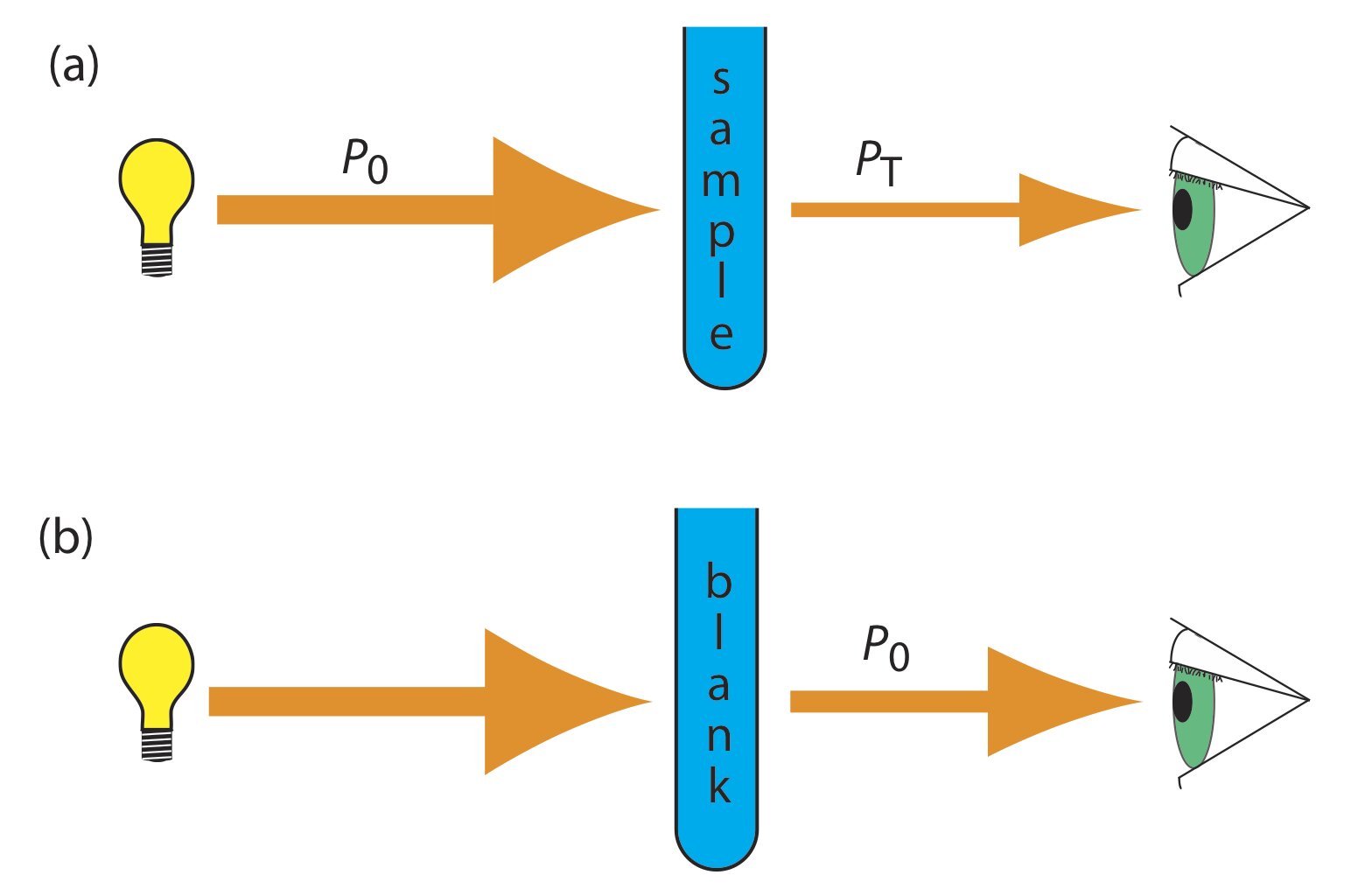
La absorbancia (A) es una medida de la cantidad de luz absorbida por una solución cuando pasa un haz luminoso a través de ella. Se expresa como una magnitud adimensional y se obtiene directamente del espectrofotómetro.
Ley de Beer-Lambert
La fórmula principal es:A=ε⋅b⋅c
Donde:
- A = Absorbancia
- ε = Coeficiente de absorción molar (L·mol⁻¹·cm⁻¹)
- b = Longitud del paso óptico en la celda (cm), normalmente 1 cm
- c = Concentración de la sustancia (mol·L⁻¹)
Reorganización para calcular la concentración

c=ε⋅bA
Cuando se conoce el coeficiente de absorción molar y la longitud del camino óptico, se puede determinar la concentración con solo medir la absorbancia.
Métodos para calcular concentración
Método directo usando ε conocido

Ideal para sustancias con valores de ε documentados. Solo se requiere medir A y aplicar la ecuación.
Ventajas
- Rápido
- No requiere curva de calibración
Desventajas
- Depende de la pureza y correcta identificación del analito
Método mediante curva de calibración
Cuando ε es desconocido o se trabaja con mezclas, se construye una recta:A=m⋅c+b
Donde m es la pendiente y b generalmente cercano a cero.
Procedimiento básico
- Preparar soluciones estándar con concentraciones conocidas
- Medir la absorbancia a la longitud de onda específica
- Graficar Absorbancia vs Concentración
- Ajustar la recta y obtener la ecuación
- Calcular la concentración de las muestras usando la ecuación
Tabla de ejemplo: Relación absorbancia-concentración
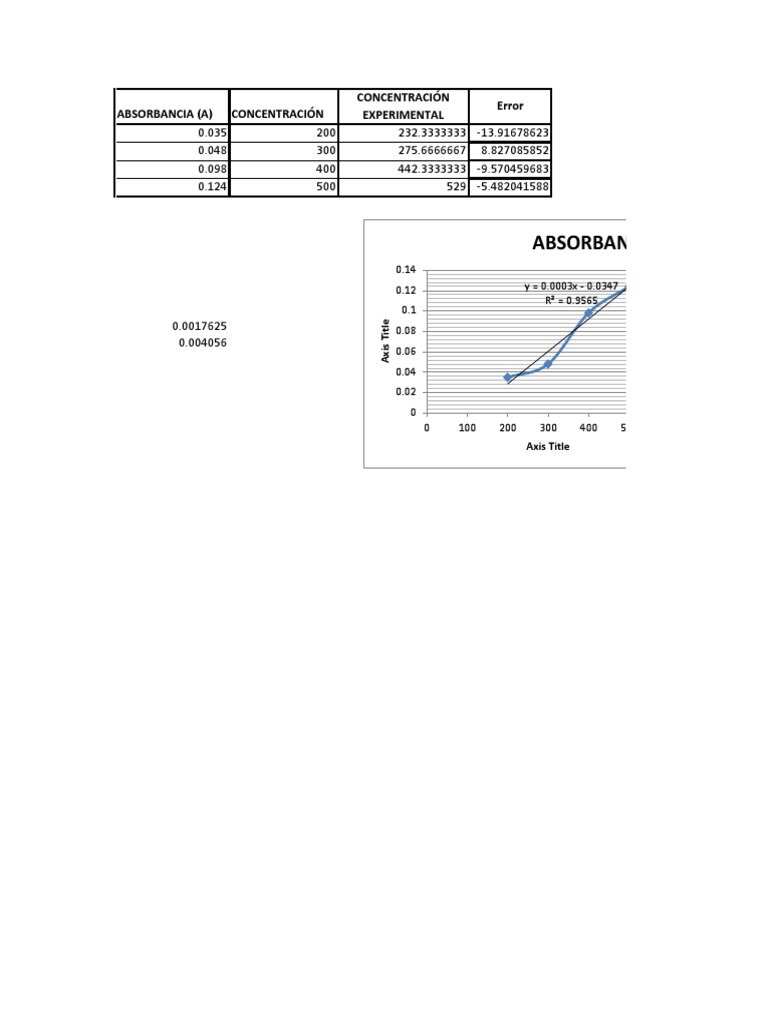
| Solución | Concentración (mol/L) | Absorbancia (A) |
|---|---|---|
| S1 | 0.01 | 0.12 |
| S2 | 0.02 | 0.25 |
| S3 | 0.03 | 0.37 |
| S4 | 0.04 | 0.50 |
| S5 | 0.05 | 0.62 |
Si la ecuación de la recta obtenida es:A=12.4⋅c+0.01
Y para una muestra la absorbancia es 0.41:0.41=12.4c+0.01⇒c=0.032 mol/L
Factores que afectan la precisión del cálculo
Parámetros instrumentales
- Longitud de onda incorrecta
- Celdas sucias o rayadas
- Desalineación del haz de luz
Condiciones fisicoquímicas
- pH variable
- Temperatura no controlada
- Reacciones secundarias del analito
Rango de linealidad
La ley de Beer-Lambert es válida solo en bajas concentraciones. Si la absorbancia supera ~1.0 A, puede haber desviaciones y requerirse dilución.
Recomendaciones prácticas
- Calibrar el equipo antes de medir
- Usar disolvente como blanco
- Preparar soluciones con material aforado
- Realizar duplicados o triplicados
- Mantener la longitud del camino óptico constante
Fórmulas útiles

| Tipo de cálculo | Ecuación |
|---|---|
| Concentración | c=ε⋅bA |
| Absorbancia | A=ε⋅b⋅c |
| Curva de calibración | A=m⋅c+b |

Deja una respuesta